Aeshna subarctica Walker, 1908 / Hochmoor-Mosaikjungfer
Synonyme
Aeschna subarctica interlineata Ander, 1944, Aeshna subarctica elisabethae Djakonov, 1922
Rechtlicher Schutz und Rote Liste
| Artenschutzrechtlicher Schutzstatus: | SG (streng geschützt) |
| Rote Liste Deutschland: | 1 ((akut) vom Aussterben bedroht) |
| Rote Liste Sachsen: | 1 ((akut) vom Aussterben bedroht) |
Allgemeine Arteninformationen
Kennzeichen
Sehr große Aeshnide („Edellibelle“) von typischer Gestalt einer „Mosaikjungfer“. Thorax dunkelbraun mit 2 oder 3 gelblichen und bläulichen Seitenbinden. Hinterleib dunkel, mit gelblicher und blauer (Männchen) bzw. gelblich grauer (Weibchen) mosaikartiger Fleckung. Eine sichere Unterscheidung von der Torf-Mosaikjungfer (Aeshna juncea) ist meist nur durch Fang möglich. Unterscheidungsmerkmale zur Torf-Mosaikjungfer sind u. a. die etwa gleiche Größe der Zeichnungselemente des Abdomens (Torf-Mosaikjungfer mit schmalen Querstreifen und deutlich größeren runden Flecken), das Fehlen der weißen oder gelblichen Hinteraugenflecken, die schwarze Linie zwischen Kopfschild und Stirn verschmälert sich seitlich nicht (gleiche Breite oder seitlich sogar erweitert), die Hinterleibsanhänge der Weibchen stehen waagerecht. Exuvien stark glänzend, Cerci reichen über die Mitte der Analpyramide hinaus
Biologie und Ökologie
Die Hochmoor-Mosaikjungfer ist streng an ausgedehnte flutende Torfmoosrasen gebunden. Sie besiedelt damit ausnahmslos nährstoffarme dystrophe Gewässer, wobei sie nicht nur reine Hochmoorbereiche, sondern auch mesotrophe Niedermoore und verlandende Torfstiche besiedeln kann, sofern flutende Torfmoosrasen vorhanden sind. Viele Fortpflanzungsgewässer befinden sich innerhalb größerer Waldgebiete. Die Imagines jagen häufig in benachbarten Waldbeständen entlang von Wegen, Waldrändern und Lichtungen und scheinen überwiegend im Kronenbereich von Bäumen zu übernachten. Die Eiablage erfolgt überwiegend in der Nähe größerer flutender Torfmoosrasen in unterschiedliche Substrate. Die Larven weisen sehr komplexe Temperaturansprüche auf, die durch Aufenthalte in unterschiedlichen Wassertiefen innerhalb der Torfmoospolster erfüllt werden. Die Larvenentwicklung dauert 3–4 Jahre.
Im Feldberggebiet wurde ein regelmäßiger Individuenaustausch über 1,5 km Luftlinie zwischen 2 Mooren beobachtet (Sternberg 1990). Funde von Individuen abseits der Vorkommensgebiete belegen größere Wanderungsdistanzen, infolge der geringen Populationsgrößen und der Seltenheit geeigneter Lebensräume ist die Ausbreitungsfähigkeit aber stark eingeschränkt. Mindestpopulationsgrößen sind unbekannt, Voraussetzungen für ein langfristiges Überleben sind aber wahrscheinlich funktionsfähige Metapopulationen.
Überregionale Verbreitung
Circumpolare, holarktische Verbreitung in Amerika, Europa und Asien. In Europa und Asien nur die Unterart A. s. elisabethae. Das eurasische Areal reicht von Westfrankreich bis Hokkaido. In Mitteleuropa kommt die Art in Arealrandlage mit starker Fragmentierung und Isolation der Populationen im Süden und Westen vor.
Erhaltungszustand
ungünstig-schlecht (Gutachterliche Bewertung)
Hinweise Erhaltungszustand
Durch ihre stenöke Bindung an nährstoffarme und damit sehr störungsanfällige Moore ist die Art zusätzlichen Risiken ausgesetzt.
Prüfung und Erfassung
Einstufung nach F+E-Projekt Artenschutzkonzeption 2012
Lokal umzusetzende Artenhilfsmaßnahmen, Priorität 1 (höchste)
Relevanz bei Eingriffen
- Forstwirtschaft
Untersuchungsstandards
Imaginalnachweise sind schwierig, an sonnigen Tagen patrouillieren die Männchen z. T. anhaltend entlang von Seggenrieden und Wollgrassäumen am Rande der flutenden Torfmoosbestände. Die sichere Bestimmung ist jedoch in der Regel ohne Fang nicht möglich. Infolge der spezifischen Habitatansprüche und der stark isolierten Populationen stellen bereits Einzelbeobachtungen an oder in der Nähe potenzieller Reproduktionsgewässer Reproduktionshinweise (Status B – Reproduktion möglich) dar. Bei Auftreten mehrerer Individuen bzw. Eiablage besteht Reproduktionsverdacht (Status C – Reproduktion wahrscheinlich). Sichere Reproduktionsnachweise (Status D – Reproduktion nachgewiesen) sind nur durch Funde von Exuvien bzw. sicher im Bereich eines Gewässers frisch geschlüpften (Emergenz) Individuen möglich.
Erfassung bzw. Reproduktionsnachweise durch mehrmalige Exuviensuche im Zeitraum Mitte Juni bis Anfang August an potenziellen Reproduktionsgewässern.
Außerhalb bekannter Vorkommensgebiete sollten Fänge durch Fotos (Kopf frontal und von hinten, Thorax und Abdomen seitlich und von oben) belegt werden. Exuvien sind zur Nachbestimmung aufzubewahren.
Sonstige Arten-Attribute
- Zielart Biotopverbund (Deutschland)
Vorkommen
Status Etablierung
Indigene, Ureinheimische (Reproduktion)
Nachweisabsicherung
Ja
Langfristiger Bestandstrend
gleichbleibend
Kurzfristiger Bestandstrend
gleichbleibend
Bestand
Die Art wurde bis in die erste Hälfte des 20. Jahrhunderts übersehen und erstmals durch Büttner auf der tschechischen Seite des Großen Kranichsees gefunden (Schiemenz 1954). Die ersten sächsischen Nachweise erfolgten Ende der 1980er Jahre (Brockhaus 1988) in den NSG Großer Kranichsee und Kleiner Kranichsee. Die westerzgebirgischen Vorkommen sind wahrscheinlich Teilhabitate einer Metapopulation, deren Schwerpunkt in den angrenzenden tschechischen Mooren zu lokalisieren ist. Systematische Untersuchungen der verbliebenen großen Moore ergaben drei weitere isolierte Populationen im Bereich der Düben-Dahlener Heide, der Muskauer Heide sowie den Königsbrück-Ruhlander Heiden. Aufgrund der fehlenden historischen Daten kann ein Rückgang zwar nicht belegt werden, infolge des historischen Verlustes potenzieller Habitatflächen ist ein langfristiger Bestandsrückgang mit deutlicher Verkleinerung der Habitatfläche und zunehmender Fragmentierung der Populationen jedoch sehr wahrscheinlich.
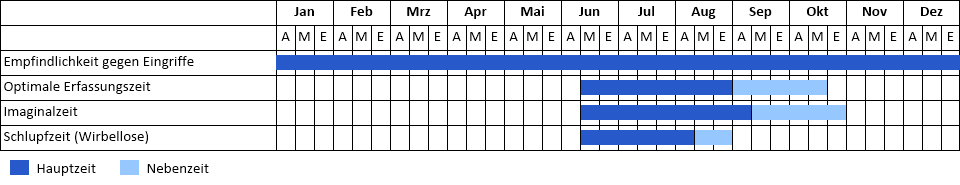
Regionales Vorkommen
- Oberlausitz/Niederschles.: Nachweis ab 1980
- Westerzgebirge/Vogtland: Nachweis ab 1980
- Westsachsen: Nachweis ab 1980
Vorkommenskarte
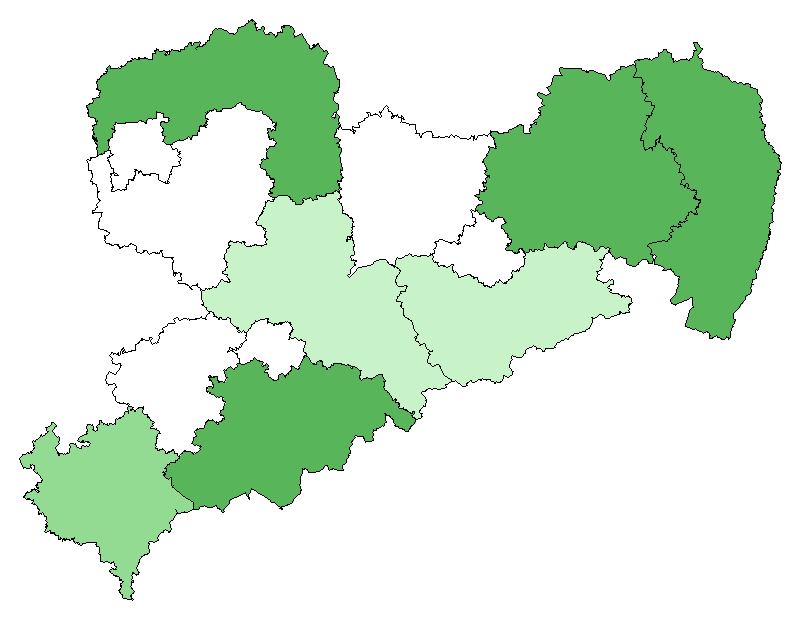
Phänologie
Phänogramm
Lebensraum
In Sachsen besteht eine strenge Bindung an großflächig flutende Torfmoosrasen. Die Art besiedelt vitale Kammhochmoore im Erzgebirge, ein Übergangsmoor in der Dübener-Dahlener Heide sowie Durchströmungs- und Waldmoore im Oberlausitzer Heideland. Alle sächsischen Vorkommensgebiete befinden sich innerhalb großer Waldgebiete.
Fortpflanzungsstätten: Reproduktionsgewässer inkl. angrenzender Riedbereiche im Umkreis von 100 m, Schwingrasen mit Dominanz flutender Torfmoose, auch verlandende Torfstiche und Schlenken sowie ungenutzte bis maximal extensiv genutzte Teiche mit großflächiger Torfmoosverlandung. Larvallebensräume bilden überwiegend die flutenden Torfmoosrasen. A. subarctica bevorzugt (nahezu) baumfreie Moorflächen von mindestens 1000 m², die einen ungehinderten Zuflug zum Reproduktionshabitat ermöglichen.
Ruhe- und Jagdstätten: Wälder im Umkreis von 1000 m um die besiedelten Moorkomplexe. Jagdgebiete sind windgeschützte Lichtungen, Waldwiesen, Schneisen und besonnte Waldrandbuchten etc. Als Ruhestätten werden überwiegend die Kronenbereiche angrenzender Wälder genutzt.
Hinweise zur Abgrenzung von Populationen: Betrachtungsmaßstab unterhalb Ebene Landkreis, i. d. R. Moorkomplex.
Langfristig stabile Vorkommen beruhen in Sachsen überwiegend auf Metapopulationen, die mehrere benachbarte Habitatflächen innerhalb von Moorkomplexen besiedeln. Diese können als Lokale Populationen aufgefasst werden. Imagines entfernen sich in der Reifezeit regelmäßig bis mehrere Kilometer vom Reproduktionsgewässer, während der Reproduktionszeit wurden regelmäßige Wechsel zwischen benachbarten Mooren nachgewiesen (Sternberg 1990). Einzelfunde abseits bekannter Vorkommen belegen Ausbreitungspotenzial. Als funktionsfähige Metapopulation ist ein lokaler Komplex von miteinander in Beziehung stehenden (max. Distanz nicht größer 5 km), erfolgreich reproduzierenden Populationen zu verstehen, die einen bestandsbezogen günstigen Erhaltungszustand aufweisen.
Habitatkomplexe
- Moore
- Wälder
Habitatkomplexe Reproduktion
- Moore
Ökologische Charakterisierung
- Moore
- Moorgewässer
Höhenstufen
- collin
- montan
- planar
Management
Beurteilung
Infolge der engen Lebensraumbindung und des guten Durchforschungsgrades der verbliebenen intakten Moore Sachsens ist von einem hohen Erfassungsgrad auszugehen. Defizite bestehen hinsichtlich der genauen Struktur der Metapopulationen (Teilhabitate) besonders unter dem Gesichtspunkt von Entwicklungsflächen zur Stabilisierung der Tieflandpopulationen.
Handlungsbedarf aus Landessicht
- Landeszielart des Biotopverbundes
Management
- Verbesserung/Sicherung der Habitateignung in Vorkommensgebieten: Gehölzentfernung (Verbesserung der hydrologischen Situation sowie Erhalt/Wiederherstellung hinreichend großer offener Habitatflächen), Verbesserung Wasserrückhalt (Grabenverschluss etc.), ggf. kleinflächige Eingriffe in den Sukzessionsverlauf zum Erhalt flutender Sphagnumrasen
- Erweiterung der Habitatflächen: Ersteinrichtende Maßnahmen auf geschädigten/devastierten Moorflächen oder im Bereich geeigneter Geländemulden (Überstauung zur Entwicklung von flutenden Sphagnumrasen), ggf. Schaffung geeigneter Geländemulden im Umfeld besiedelter Moore. Entwicklungsflächen sollten eine Mindestgröße von 1000 m² nicht unterschreiten.
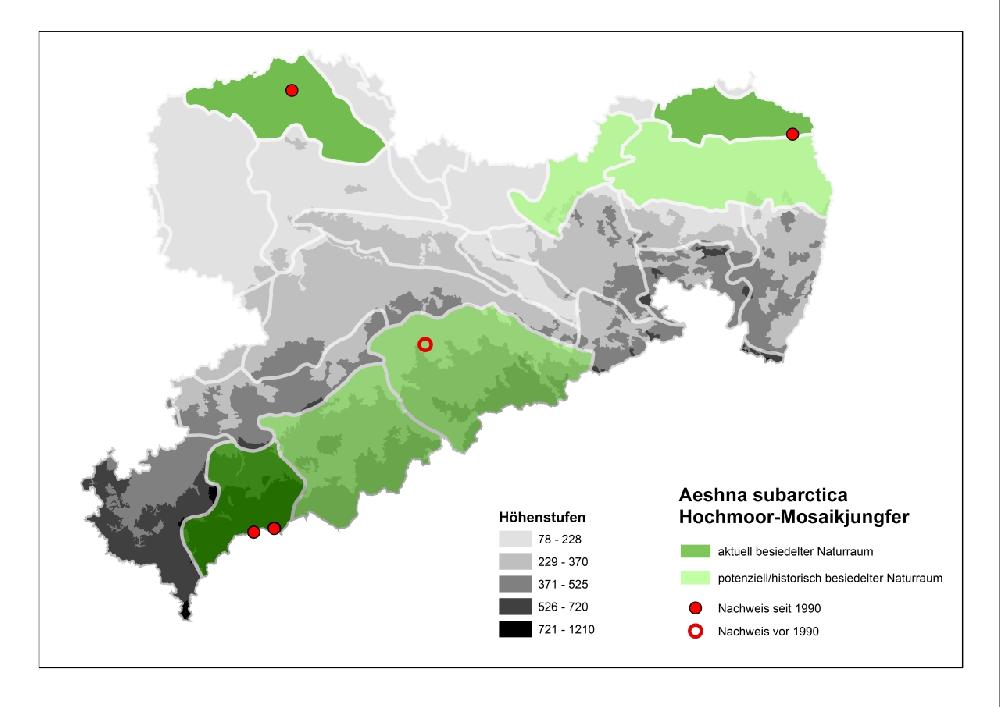
Karte zur Schutzstrategie
Gefährdungen
- Beeinträchtigung der Vegetation und Beschleunigung der Sukzession der Reproduktionsgewässer durch diffuse Nährstoffeinträge (Luftpfad)
- hydrologische Störungen (Entwässerung, Trockenphasen)
- warme Sommer können zur Gefährdung der Art im Tiefland führen, da die Larven dann nur noch in tieferen Wasserschichten geeignete Temperaturen vorfinden, diese jedoch starke Sauerstoffdefizite aufweisen
- Risikofaktoren: Seltenheit, Kleinflächigkeit und starke Isolation der Habitate
Sonstiges
Literatur
- Brockhaus, T. (2005): Hochmoor-Mosaikjungfer Aeshna subarctica elisabethae Djakonov, 1922. – In: Brockhaus, T. & U. Fischer (Hrsg.): Die Libellenfauna Sachsens. – Natur & Text Rangsdorf: 179–181.
- Günther, A., M. Olias & T. Brockhaus (2006): Rote Liste Libellen Sachsens. – Materialien zu Naturschutz und Landschaftspflege 2006, 20 S.
- Olias, M. & K. Burbach (2005): Libellen (Odonata). – In: Günther, A., U. Nigmann, R. Achtziger & H. Gruttke (Bearb.): Analyse der Gefährdungsursachen von planungsrelevanten Tiergruppen in Deutschland. – Naturschutz und Biodiversität 21: 351–385.
- Peters, G. (1987): Die Edellibellen Europas. Aeshnidae. – Die Neue Brehm-Bücherei Bd. 585. – A. Ziemsen Verlag, Wittenberg Lutherstadt, 140 S.
- Peters, G. (2008): Abnahme der Großlibelle Aeshna subarctica auf den Rheinsberger Hochmooren und mögliche Ursachen. – Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin (N.F.) 47: 119–125.
- Schorr, M. (1990): Grundlagen zu einem Artenhilfsprogramm Libellen der Bundesrepublik Deutschland. – Societas Internationalis Odonatologica (S.I.O.) Bilthoven: 243–248.
- Sternberg, K. (1990): Autökologie von sechs Libellenarten der Moore und Hochmoore des Schwarzwaldes und Ursachen ihrer Moorbindung. – Inaugural-Dissertation, Albert-Ludwigs-Universität Freiburg i. Br., 431 S.
- Sternberg, K. (2000): Aeshna subarctica elisabethae Djakonov, 1922. Hochmoor-Mosaikjungfer. – In: Sternberg, K. & R. Buchwald (Hrsg.): Die Libellen Baden-Württembergs. Band 2: Großlibellen (Anisoptera). – Eugen Ulmer, Stuttgart: 93–109.
Bearbeitungsstand und Bearbeiter des Artensteckbriefes
Offizieller Artensteckbrief des LfULG; Stand: 10.02.2014; Bearbeiter: Dr. André Günther und Marko Olias (Naturschutzinstitut Freiberg); Hinweise und Änderungsvorschläge bitte an: Heiner.Blischke@smul.sachsen.de
Legende zum Artensteckbrief unter: http://www.umwelt.sachsen.de/umwelt/natur/22872.htm; Informationen zur Artengruppe für Sachsen: http://www.umwelt.sachsen.de/umwelt/natur/22988.htm