Fallopia japonica (Houtt.) Ronse Decr. / Japan-Staudenknöterich
Synonyme
Japanischer Flügelknöterich, Polygonum cuspidatum Siebold & Zucc., Polygonum reynoutria Makino, Polygonum zuccarinii Small, Tiniaria cuspidata (Houtt.) Hedb., Pleuropterus cuspidatus (Siebold & Zucc.) H.Gross
Rechtlicher Schutz und Rote Liste
| Rote Liste Sachsen: | (*) |
Allgemeine Arteninformationen
Kennzeichen
Sommergrüne, schnellwüchsige, meist bis 2,5 m große Rhizomstaude, bildet durch unterirdische Ausläufer mit vielen aufrechten kräftigen, hohlen Sprossen oft Herden. Blätter 10-20 cm lang, breit eiförmig mit aufgesetzter schmaler Spitze, am Grund rechtwinklig gestutzt, lederartig, kahl, jedoch am Blattrand und auf den Nerven unterseits mit kurzen, haarähnlichen Papillen. Stängel deutlich rot gefleckt, ein großes Grubennektarium (drüsige Vertiefung) am Blattstielgrund. Blüten weiß, Blütenstände blattachselständig, rispig, die weibliche Blüte gestreckt, die männliche Blüte halb aufrecht. Fruchtansatz mäßig; in Deutschland meist weibliche Pflanzen. Verwechslungsmöglichkeit mit Fallopia sachalinensis (mit meist deutlich größeren Blättern, die am Grunde herzförmig) und Fallopia x bohemica (mit intermediären Merkmalen).
Biologie und Ökologie
Wuchsverhalten: Die Konkurrenzstärke und auch Persistenz von Fallopia japonica gründet sich auf die erhebliche Wuchshöhe, den speziellen Sprossaufbau und Beblätterung und die sehr effektive vegetative Ausbreitung und Regenerationskraft. Die Sprosse treiben Anfang April aus und legen in der Hauptwachstumsphase von Mai bis Mitte Juni bis zu 15 cm pro Tag zu. Dieser Vorteil wird verstärkt durch die zweizeilige, großflächige Beblätterung und damit dem Lichtentzug potenzieller Konkurrenten. Nach den ersten Herbstfrösten sterben die oberirdischen Pflanzenteile ab.
Vegetative Ausbreitung: Unterirdische Ausläufer und Rhizome (ca. zwei Drittel der Biomasse in den meist horizontal wachsenden Rhizomen gebunden, die einen Durchmesser von bis zu 10 cm erreichen können). Aus Rhizomknospen können neue Luftsprosse oder weitere Verzweigungen des Rhizoms gebildet werden, so erweitern sich Bestände bis zu einem Meter pro Jahr. Aus kleinsten Rhizomteilen (1-1,5 cm groß) mit Knospen gelingt die vegetative Regeneration.
Generative Ausbreitung: Fruchtansatz mäßig, Bildung keimfähiger Samen mit Wind-, Klett-, Ameisen- und Selbstausbreitung, Generative Verbreitung im Vergleich zur vegetativen Verbreitung jedoch deutlich nachrangig.
Verbreitungswege: Höchst effektive Fernausbreitung freigespülter und abgerissener Rhizomabschnitte und Sprossteile durch Verdriftung entlang von Fließgewässern v.a. bei Hochwässern. Weiterhin erfolgt die Verbreitung durch Erdaushub.
Überregionale Verbreitung
Herkunftsgebiet: ozeanische Gebiete Ostasiens (China, Korea, Japan)
Aktuelle Verbreitung in Europa: Der Japan-Knöterich ist in Mittel- und Westeuropa (Dänemark, Frankreich, Österreich, Schweiz, Norwegen, Großbritannien etc.) häufig und verbreitet. In den Nachbarländern gilt er als eine der wichtigsten neophytischen Problempflanzen. In Mitteleuropa ist F. japonica wesentlich häufiger als F. sachalinensis.
Aktuelle Verbreitung in Deutschland: häufig und verbreitet
Prüfung und Erfassung
Sonstige Arten-Attribute
- Naturschutzfachliche Invasivitätsbewertung für gebietsfremde Gefäßpflanzen (BfN-Skripten 352)
Vorkommen
Status Etablierung
Neobiota, etabliert
Bemerkungen Neobiota
(*) Neobiota etabliert, stabil oder in Ausbreitung befindlich
Nachweisabsicherung
Nein
Langfristiger Bestandstrend
deutliche Zunahme
Kurzfristiger Bestandstrend
deutliche Zunahme
Bestand
Aktuelle Verbreitung in Sachsen: Der Japanische Staudenknöterich ist in den relevanten Lebensräumen in Sachsen flächendeckend verbreitet. Innerhalb der letzten zwei Jahrzehnte ist eine sehr starke Ausbreitung, des Japanischen Staudenknöterichs, insbesondere entlang von Wasserläufen, zu erkennen.
Verbreitung und Einbürgerung
Einbürgerungszeit: 1823 als Zierpflanze nach Europa (Holland) eingeführt, 1872 bei Zwickau nachgewiesen; von Fiedler (1959) nicht als eingebürgerte Art in der Umgebung von Leipzig aufgeführt
Einbürgerungsgrad in Sachsen: neuheimisch, d. h. auch in naturnaher Vegetation etabliert und sich haltend.
Einbürgerungsweise: Nach Pflanzung als Garten- und Parkpflanze, als Wild- und Viehfutterpflanze sowie zur Begrünung von Halden verwildernd und stark ausbreitend; Förderung auch durch Gewässerausbau.
Vorkommenskarte
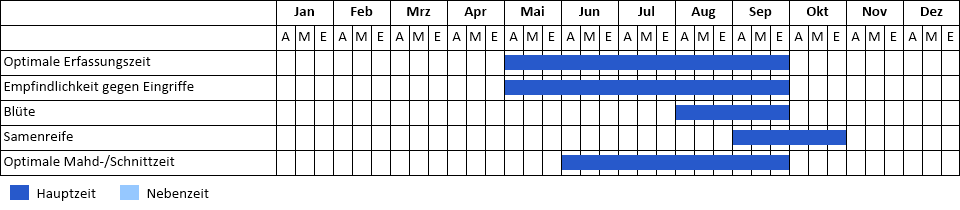
Phänologie
Phänogramm
Lebensraum
Lebensraum im Herkunftsgebiet: breite Standortsamplitude, in Japan sowohl auf trocken-mageren Kiesböden als auch auf nährstoffreichen nassen Böden; ruderal sowie in Auwäldern, Flussbänken und –schottern, auf nassen nitrathaltigen Standorten, Fels- und Schutthalden sowie auf vulkanischen Aschen und frischen Lavafeldern, fördert auf vulkanischen Böden die Bodenentwicklung und damit die Sukzession.
Lebensraum in Sachsen: Die Staudenknöteriche sind sehr anspruchslos. Sie bevorzugen feuchte und grundwassernahe Böden, jedoch ohne längere Überflutungen. Sie gedeihen auch gut auf trockenen Standorten. Die Knöteriche bilden vor allem dichte Dominanzbestände an gehölzfreien Bach- und Flussufern. Häufig sind sie auf Ruderalflächen, wie z. B. an Straßenrändern, auf Bahndämmen, Böschungen, Industriebrachen sowie an frischen bis feuchten Wald- und Gebüschsäume und im Wald zu finden. Die Staudenköteriche bevorzugen lichte Standorte, wachsen aber auch im Halbschatten. Im tiefen Schatten bilden sie meist nur schüttere Bestände. Die Wärmeansprüche sind gering. Der Japanische Staudenknöterich bevorzugt Gebiete mit hohen und häufigen Niederschlägen und meidet extreme Klimabedingungen.
Ökologische Charakterisierung
- Offene Landschaft mit Hecken, Feldgehölzen, Waldsäumen, Alleen
- Ufer
Höhenstufen
- collin
- montan
- planar
Management
Beurteilung
Naturschutzfachliche Beurteilung: F. japonica ist eine naturschutzfachlich äußerst problematische Art. Durch den Aufbau dichter Dominanzbestände an Bach- und Flussufern führt diese zur Verdrängung heimischer Pflanzen- und Insektenarten. Zudem zeichnet sie sich durch eine außerordentlich hohe Konkurrenzkraft, starkes Wuchsverhalten und effiziente Regenerationsfähigkeit aus. Es kommt zur Verzögerung der Sukzession an gehölzarmen Gewässerrändern zu Auwäldern. Neben der Abnahme der Arten- und Gesellschaftsdiversität gehen auch Nahrungsquellen für verschiedene Insektenarten und ihre Entwicklungsstadien verloren; wichtige Arten für die Wildbienenweide (z. B. Lysimachia vulgaris) werden ebenso verdrängt wie Raupenfutterpflanzen (Fillipendula ulmaria u. a.). Eine Förderung des Invasionsrisikos durch Klimawandel wird angenommen.
Betroffene Schutzgüter:
• Feuchte Hochstaudenfluren
• Feuchtgrünland
• naturnahe Auenwälder (Weichholzaue)
Wirtschaftliche Beurteilung: Ernsthafte Probleme für Hochwasserschutz und Wasserwirtschaft: Bestände an Böschungen, insbesondere entlang von Fließgewässern, erhöhen die Erosionsanfälligkeit. Die Bestände können den Hochwasserabfluss behindern und den Zugang der Ufer zur Gewässerpflege beschränken. An Kanalisation, Straßenbelägen, Stütz- und Schutzmauern sowie Gebäuden können Schäden auftreten. An Brücken und Straßenrändern kann es zu Sichtbehinderungen kommen. Der erforderliche Pflegeaufwand verursacht erhebliche Kosten.
Ökonomische Vorteile bietet die Art in der Landwirtschaft durch Nutzung von Extrakten als Nahrungsergänzungsmittel und zur Bioenergienutzung sowie für die Jagd als Deckungs- und Äsungspflanze. Extrakte des Japan-Staudenknöterichs finden im biologischen Landbau gegen Krautfäule an Tomaten und Grauschimmel an Paprika Verwendung.
Negative gesundheitliche Auswirkungen: keine gesundheitlichen Auswirkungen bekannt oder zu erwarten
Wissensdefizite in Sachsen:
• Ausbreitungsgeschwindigkeit unter sich verändernden Standortsbedingungen
• trotz der Erprobung eines breiten Spektrums an Bekämpfungsmaßnahmen: effektive Steuerungsmöglichkeiten unbekannt
• Rückgang der Ausbreitungsgeschwindigkeit
Fazit für Sachsen: Für die in Sachsen sich sehr stark ausbreitenden und naturschutzfachlich äußerst prekären Fallopia-Sippen, die zugleich zu den einhundert weltweit problematischsten Neophyten gehören, werden einzelfallbezogene Entscheidungen für Maßnahmen empfohlen. Der Handlungsbedarf ergibt sich vor allem aus naturschutzfachlicher und wasserwirtschaftlicher Sicht bzw. dem Hochwasserschutz. Eine landesweite Bekämpfung ist aufgrund der Kosten nicht realistisch.
Management
Präventive Maßnahmen: Da die direkte Bekämpfung mit sehr hohem Aufwand und Kosten sowie oft mit unzureichendem Erfolg verbunden ist, sollte die Vorbeugung stärker berücksichtigt werden. Dazu zählen:
- Förderung konkurrenzfähiger, natürlicher Pflanzengesellschaften an gefährdeten Bereichen, so z. B. Gehölze an naturnahen Gewässerabschnitten
- Aufklärung von Gartenbesitzern und Förstern bzw. Jägern, um weitere unbedachte Anpflanzungen sowie die Verschleppung mit Gartenabfällen und Erde zu verhindern
- Verwendung von Erde bei Flussbau- und Auffüllarbeiten, die frei von Knöterich-Rhizomen ist
- Bekämpfung einzeln auftretender Pflanzen, die große Folgepopulationen bilden können
- Zur Früherkennung ist ein systematisches Monitoring von Vorkommen v.a. in der Nähe von gefährdeten Biotopen empfehlenswert (Schmiedel et al. 2015).
Bekämpfungsstrategien:
1. Mechanisch: Mahd und Beweidung schwächen die Bestände. Im Sommer gemähte Knöterich-Bestände regenerieren ihr Sprosssystem jedoch meist innerhalb derselben Vegetationsperiode. Zu einer erfolgreichen Zurückdrängung der Dominanzbestände ist daher eine regelmäßige Mahd durchzuführen, sobald die Sprosse eine Höhe von 40 cm erreicht haben. Im ersten Jahr sollte die Mahdfrequenz bei 6-8 Schnitten liegen, im dritten Jahr sind noch immer mind. 4-6 Arbeitseinsätze erforderlich. Die negative Folge dieser Maßnahme ist eine aus naturschutzfachlicher Sicht nicht wünschenswerte dichte Grasnarbe. Verringert man die Mahdfrequenz kommt es nur zu einer Schwächung des Fallopia Bestandes bei gleichzeitiger Erhöhung des Anteils der Grünlandarten. Eine Beweidung mit Schafen ist erfolgsversprechend, da Fallopia gegenüber anderen Kräutern und Gräsern bevorzugt wird, wenn auch frisch ausgetriebene Blätter gemieden werden. Nach einer 2-jährigen Beweidung mit gekoppelten Schafen waren in einer Fallstudie nur noch schwach und vereinzelt Neuaustriebe zu beobachten.
Eine weitere Möglichkeit ist die Überpflanzung der Bestände mit Weiden. Diese Methode ist an Gewässerufern und bei nicht zu weit landeinwärts vordringenden Knöterichbeständen anwendbar. Weidenspreitanlagen sollen im Frühjahr bei Frostfreiheit und vor dem Austreiben des Knöterichs über den gesamten Bestand und mindestens einen Meter darüber hinaus angelegt werden. Die aufkommenden Knöterichsprosse müssen gemäht oder ausgerissen werden. Rhizombelastete Böden sollten kompostiert werden. Mit einem Zusatz von Frischkompost zu gleichen Teilen erhält man so einen marktfähigen Kompost.
Nicht zu empfehlende Maßnahmen:
- ätzende, thermische Verfahren und Infrarotbestrahlung sowie das manuelle Ausgraben von Rhizomen, das Abschlagen oder Ausreisen der Triebe erwiesen sich als ungeeignet (Böhmer et al. 2001)
- Abdecken mit lichtundurchlässiger Folie ist nicht erfolgversprechend, da die Pflanze mit Hilfe ihrs Rhizomsystems die Maßnahme überdauert
- flächige oder lokale Herbizidanwendung mit dem Wirkstoff Glyphosat gilt als effizientes Verfahren, ist aber mit erheblichen Risiken für die Umwelt und die menschliche Gesundheit verbunden (Schmiedel et al. 2015). Glyphosat darf nach §12 Abs.2 PflSchG grundsätzlich nicht - höchstens mit Ausnahmegenehmigung - unmittelbar an oberirdischen Gewässern angewandt werden.
Handlungsbedarf: Aufgrund der effizienten Regenerationsfähigkeit der Pflanze ist vorher genau zu prüfen, ob im Einzelfall das Ziel den Aufwand rechtfertigt und ob eine Finanzierung der Maßnahme über die notwenige Dauer gesichert ist.
Für das Management von Neobiota in Sachsen beachten Sie auch die offiziellen Seiten des Staatsministeriums für Umwelt und Landwirtschaft (SMUL): http://www.umwelt.sachsen.de/umwelt/natur/34835.htm ; insbesondere auch die Arbeitshilfen: http://www.umwelt.sachsen.de/umwelt/natur/34838.htm
Zentrales Medium für die Sammlung von Artdaten in der Naturschutzverwaltung des Freistaates Sachsen ist die Zentrale Artdatenbank beim LfULG: http://www.umwelt.sachsen.de/umwelt/natur/8048.htm ;
Aktuelle Übersichtskarten der Verbreitung von Arten in Sachsen können unter folgendem Link abgerufen werden: http://www.umwelt.sachsen.de/umwelt/infosysteme/cadenzaweb2014/commands.xhtml?Login.Anonymous</p Meldungen an die Regionalverantwortlichen der Arbeitsgemeinschaft sächsischer Botaniker (AGsB) werden jährlich in die Zentrale Artdatenbank übernommen.
Weitere Informationen
http://www.nabu-sachsen.de/index.php?option=com_content&view=article&id=1186&Itemid=961 https://publikationen.sachsen.de/bdb/artikel/15224/documents/18368
Handlungsbedarf Neobiotamanagement

Handlungsbedarf für ein Management in zahlreichen Einzelfällen vorhanden
Sonstiges
Literatur
Sachsen:
Arndt, E., Piechulek, E., K. & Phoenix, J. (2008): Invasive Neophyten in Bachtälern des Nationalparks Sächsische Schweiz. Sächsische Floristische Mitteilungen 11, S. 3 - 24.
Fiedler, O. (1959): Die eingebürgerten und sich einbürgernden Pflanzen in der Umgebung von Leipzig während der Zeit von 1900 bis zur Gegenwart. Msk.27 Schreibmaschinenseiten , Original im ehemaligen Botanischen Institut, Abschrift im Besitz von Gutte, P. (Leipzig).
Gutte, P. (2006): Flora der Stadt Leipzig einschließlich Markkleeberg. Weissdorn-Verlag, Jena, 278 S.
Gutte, P., Hardtke, H.-J., & Schmidt, P. (2013): Die Flora Sachsens und angrenzender Gebiete. Ein pflanzenkundlicher Exkursionsführer. Quelle & Meyer Verlag, Wiebelsheim, 983 S.
Hardtke, H.-J, Klenke, F. & Müller, F. (2013): Flora des Elbhügellandes und angrenzender Gebiete. Sandstein-Verlag Dresden, 718 S.
Klotz, S. & Gutte, P. (1991): Zur Soziologie einiger urbaner Neophyten. Hercynia N. F., Leipzig 28 (1), S. 45-61.
Kosmale, S. (1981): Die Einwanderung von Reynoutria japonica HOUTT. Bereicherung unserer Flora oder Anlass zur Besorgnis? Flor. Mitteilungen d. Ges. f. Natur u. Heimat Bez. Dresden, 3, 6-11.
Kosmale, S. (1990): Die Ruderalflora der Stadtkernrekonstruktionsgebiete von Zwickau und Crimmitschau. Sächsische Floristische Mitteilungen, S. 56-66.
Kosmale, S. (2000): Einwanderung und Ausbreitung gebietsfremder Pflanzen – aus der Sicht des westsächsischen Erzgebirgsvorlandes – kritisch betrachtet. Pulsatilla - Zeitschrift für Botanik und Naturschutz, 3, S. 23-29.
Rölke, P. (2004): Massenverbreitung nicht einheimischer Arten in Tälern der Nationalpark-Region. Sächsische-Schweiz-Initiative 21, http://www.ssi-heft.de/21/06.php Sächsisches Landesamt für Landwirtschaft (Hrsg., 2006): Informationsschrift Staudenknöteriche. Japanischer, Sachalin- und Böhmischer Knöterich. Faltblattreihe Integrierter Pflanzenschutz, Heft 6.
Von Zitzewitz, J. (1999): Die Reynoutria-Arten am Fließgewässersystem der Weißeritz und im Tharandter Wald. Dipl.arbeit TU Dresden, Fachrichtung Forstwissenschaften.
Weber, R. (1992): Zu Flora und Vegetation des Ostvogtlandes und des angrenzenden Westerzgebirges. Sächsische Floristische Mitteilungen 2, S. 4-9.
Weiterführende Literatur:
Alberternst, B. (1995): Kontrolle des Japan-Knöterichs an Fließgewässern. II. Untersuchungen zu Biologie und Ökologie der neophytischen Knöterich-Arten. Handbuch Wasser 2, Teil II. Landesanstalt für Umweltschutz Baden-Württemberg, Karlsruhe.
Alberternst, B. (1998): Biologie, Ökologie, Verbreitung und Kontrolle von Reynoutria-Sippen in Baden-Württemberg. Culterra 23, 198 S. Alberternst, B., Bauer, M., Böcker, R. & Konold, W. (1995): Reynoutria-Arten in Baden-Württemberg - Schlüssel zur Bestimmung und ihre Verbreitung entlang von Fließgewässern. Floristische Rundbriefe 29, S. 113-124.
Beerling, D. J., Bailey, J. P. & Conolly, A. P. (1994): Fallopia japonica (Houtt.) Ronse Decraene (Reynoutria japonica Houtt.; Polygonum cuspidatum Sieb. & Zucc.). - Journal of Ecology 82, S. 959-979.
Böhmer, H. J., Heger, T. & Trepl, L. (2001): Fallstudien zu gebietsfremden Arten. - Texte des Umweltbundesamtes 2001 (13), 126 S. Kleinbauer, I., Dullinger, S., Klingenstein, F., May, R., Nehring, S. & Essl, F. (2010): Ausbreitungspotenzial ausgewählter neophytischer Gefäßpflanzen unter Klimawandel in Deutschland und Österreich. BfN-Skripten 275, 76 S.
Böhmer, H. J. Heger, T. Alberternst, B. & Walser, B. (2006): Ökologie, Ausbreitung und Bekämpfung des Japanischen Staudenknöterichs (Fallopia japonica) in Deutschland. Anliegen Natur 30. S. 29-30.
Kowarik, I. (2010): Biologische Invasionen. Neophyten und Neozoen in Mitteleuropa, 2. Aufl. Ulmer, Stuttgart: 492 S.
Kretz, M. (1994): Kontrolle des Japan-Knöterichs an Fließgewässern. I. Erprobung ausgewählter Methoden. Handbuch Wasser 2, Teil I. Landesanstalt für Umweltschutz Baden-Württemberg, Karlsruhe. Merkblatt Zugespitzter oder Japan-Knöterich. Problempflanzen. Fachstelle Naturschutz Kanton Zürich.
Nehring, S., Kowarik, I., Rabitsch, W. & Essl, F. (2013): Naturschutzfachliche Invasivitätsbewertungen für in Deutschland wild lebende gebietsfremde Gefäßpflanzen. BfN-Skripten 352. http://www.bfn.de/fileadmin/MDB/documents/service/skript352.pdf.
Nentwig, Prof. Dr. W. (2010): Invasive Arten. Haupt Verlag, Bern. Sukopp, H. & Sukopp, U. (1988): Reynoutria japonica Houtt. in Japan und in Europa. - Veröffentlichungen des Geobotanischen Instituts der ETH, Stiftung Rübel Zürich 98, S. 354-372.
Schmiedel, D., Wilhelm, E.-G., Nehring, S., Scheibner, C., Roth, M. & S. Winter (2015): Management-Handbuch zum Umgang mit gebietsfremden Arten in Deutschland. Band 1: Pilze, Niedere Pflanzen und Gefäßpflanzen. Naturschutz und Biologische Vielfalt 141/1. Bonn- Bad Godesberg, Landwirtschaftsverlag.
Sukopp, H. & Schick, B. (1993): Zur Biologie neophytischer Reynoutria-Arten in Mitteleuropa. Morphologie der Laubblätter. Natur und Landschaft 76, S. 503-505. Zentralverband Gartenbau (2008): Umgang mit invasiven Arten. Empfehlungen für Gärtner, Planer und Verwender. Zentralverband Gartenbau, 37 S., http://www.g-net.de/download/Empfehlung-Invasive-Arten.pdf
Links:
Informationen zu einem neuen Projekt zu Bekämpfungsmaßnahmen im Dreiländereck von Deutschland, der Schweiz und Frankreich (http://www.neobiota.de/fileadmin/NEOBIOTA/documents/PDF/fallopia_cabi_project.pdf )
http://neobiota.naturschutzinformationen-nrw.de/site/nav3/ArtInfo.aspx?Art=Pflanzen&ID=72d2a557-dfb4-4e01-8504-b9a3756ecec1 , abgerufen am 12.02.2015
http://www.neobiota.de/12646.html , abgerufen am 12.02.2015
http://www.korina.info/?q=node/90 , abgerufen am 12.02.2015
http://www.g-net.de/download/Empfehlung-Invasive-Arten.pdf
https://www.smul.sachsen.de/lfulg/download/Nachlese_Doebeln_Neue-Unkraeuter.pdf
Bearbeitungsstand und Bearbeiter des Artensteckbriefes
Offizieller Artensteckbrief des LfULG; Stand: 05.07.2015; Erstbearbeitung: Prof. Dr. P. A. Schmidt, Dr. E.-G. Wilhelm
Überarbeitung: Dr. Uta Kleinknecht, Uta Glinka (IVL);
Hinweise und Änderungsvorschläge bitte an: dietmar.schulz@smul.sachsen.de
Legende zum Artensteckbrief unter: http://www.umwelt.sachsen.de/umwelt/natur/22872.htm
Informationen zur Artengruppe für Sachsen: http://www.umwelt.sachsen.de/umwelt/natur/23411.htm
Informationen zu Neobiota: http://www.umwelt.sachsen.de/umwelt/natur/34835.htm